Os processos de obtenção industrial de vários compostos químicos podem ser mais complexos do que parece. Muita gente se pergunta como várias coisas são produzidas: lápis, papéis, comidas, eletrodomésticos e carros. Mas como é produzido um ácido? Como eu consigo um metal em sua forma mais simples? Existe mais de uma forma para se obter a mesma substância? Estas perguntas são muito pertinentes nos estudantes ávidos por conhecimento químico.
Vamos aqui descobrir como é produzido o H2SO4 e HNO3, dois dos ácidos mais conhecidos comercialmente e, inclusive, os mais cobrados no vestibular. A obtenção desses ácidos, como será verificado, é feita em algumas etapas, e, industrialmente, cada uma dessas etapas tem que ser analisada, verificando-se o custo, o impacto ambiental, tempo de duração e rendimento do processo, podendo apenas então confirmar-se a sua utilidade.
Obtenção do Ácido Sulfúrico:
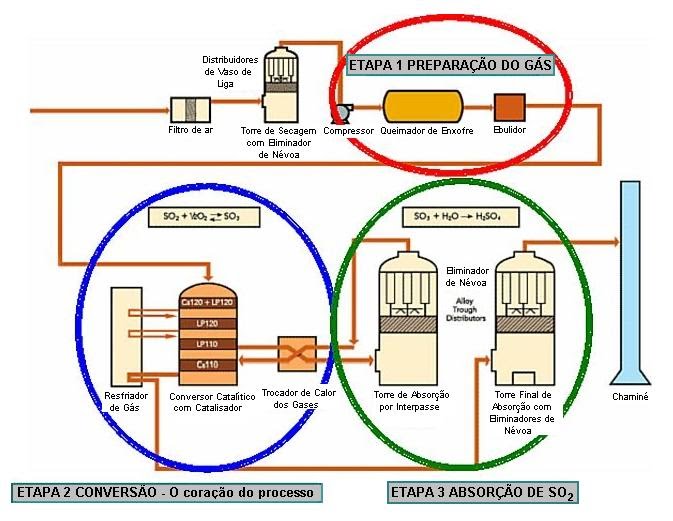
O processo industrial de obtenção do H2SO4 é conhecido no meio científico como Processo de Contato, inventado pelo comerciante britânico Peregrine Phillips e patenteado em 1831. O ácido é produzido a partir de enxofre, oxigênio e água.
1° Etapa: O enxofre sólido sofre combustão, formando dióxido de enxofre.
S(s) + O2(g) → SO2(g)
2° Etapa: O SO2 é oxidado a trióxido de enxofre ao reagir com o O2, na presença de Pentóxido de Vanádio (V2O5).
2SO2(g) + O2(g) → 2SO3(g)
3° Etapa: O trióxido de enxofre é lavado com água e assim forma o ácido sulfúrico.
SO3(g) + H2O(l) → H2SO4(l)
Obs: Obviamente este não é o único processo de obtenção do ácido sulfúrico, contudo o principal e mais conhecido. Atualmente existe um processo onde o ácido em questão é produzido pela queima do ácido sulfídrico. Este processo é conhecido como Processo de ácido Sulfúrico a úmido.
Muitas vezes, principalmente em questões de termoquímica e de estequiometria, é necessário que faça uma reação global para uma série de reações onde o produto de uma é o reagente da outra. Para monta-la é necessário que as reações sejam somadas, ignorando os compostos intermediários que são produzidos e que também reagem, obviamente estando em uma proporção estequiométrica lógica, tal como no exemplo abaixo:
2S(s) + 2O2(g) → 2SO2(g) (x2)
2SO2(g) + O2(g) → 2SO3(g)
2SO3(g) + 2H2O(l) → 2H2SO4(l) (x2)
+_________________________________________________________
2S(s) + 3O3(g) + 2H2O(l) → 2H2SO4(g) (Reação Global)
Obtenção do Ácido Nítrico:
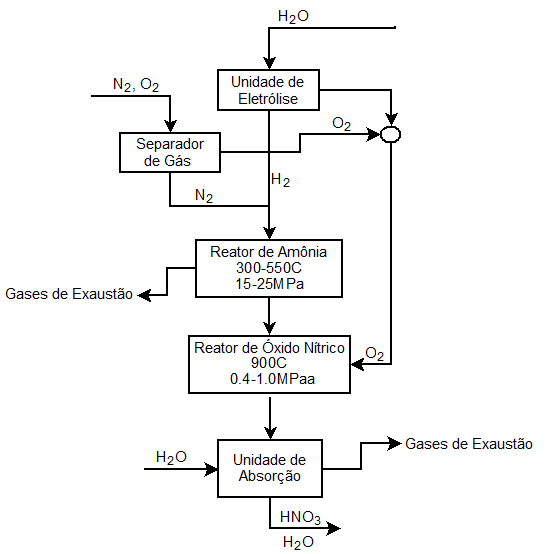
A produção do HNO3 se dá por meio do método conhecido no meio científico como Processo de Ostwald. Neste processo é utilizado a amônia, água e gás oxigênio.
1° Etapa: A amônia sofre combustão sobre telas catalíticas de platina, formando monóxido de nitrogênio.
4NH3(g) + 5O2(g) → 4NO(g) + H2O(g)
2° Etapa: O NO é oxidado a monóxido de nitrogênio.
2NO(g) + O2(g) → 2NO2(g)
3° Etapa: O NO2 é capturado sob pressão pela água, formando o ácido nítrico, liberando como subproduto NO.
3NO2(g) + H2O(l) → 2HNO3(l) + NO(g)
Antes do processo de Ostwald, era utilizado o métode de síntese do arco voltaico, onde o ar era submetido a uma corrente de 3000°C, formando NO. além do processo através da Reação do Nitrato de sódio com o Ácido Sulfúrico. Contudo, o barateamento do Processo Haber-Bosch, de síntese da amônia, tornou o Processo de Otswald o mais rentável e mais comumente utilizado.
Como no caso anterior, a reação global do processo se dá por:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
6NO(g) + 3O2(g) → 6NO2(g) (x3)
6NO2(g) + 2H2O(l) → 4HNO3(l) + 2NO(g) (x2)
+________________________________________________________________________
4NH3(g) + 8 O2(g) + 2H2O(l) → 4HNO3(l) + 6H2O(g)

Para mais conteúdo sobre Química e tantas outras matérias, fique ligado no nosso blog! Assuntos como esse e tantos outros são abordados de várias formas diferentes no nosso Curso Foca na Medicina, especial para aquele quer uma dose extra de Química e Biologia!







